AlphaFold 3重磅问世,准确性远超以往水平,给研究者“戴上一副高清眼镜”
2024-05-24 来源:翻译狗
导读
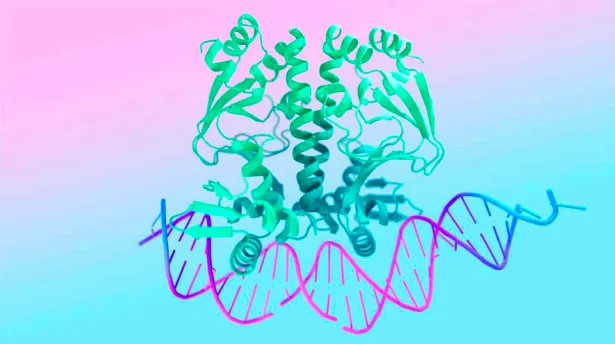
5月9日,《自然》杂志最新重磅论文,DeepMind与Isomorphic Lab联手推出最新的AlphaFold 3系统。该平台是在AlphaFold 2模型架构以及训练系统大幅提升下,可对大量生物分子系统结构进行更准确的预测。

AlphaFold首次于2020年问世,它和此后升级的AlphaFold 2能根据蛋白质的氨基酸(蛋白质的基本成分)序列预测其3D结构。之后的AlphaFold-Multimer推动了对蛋白质-蛋白质复合物的预测。
不过,扩大单一深度学习模型能预测的复合物一直很难,因为不同类型的特异性相互作用差异太大。此次发布的AlphaFold 3能预测蛋白质与其他蛋白质、核酸、小分子、离子、修饰蛋白质残基的复合物,以及抗体-抗原的相互作用,准确性显著超过当前的预测工具。
齐 萱 | 撰文
AlphaFold又迭代了!5月9日,AlphaFold3问世。
最新一期《自然》论文报道,AlphaFold 3能以较高准确率预测蛋白质与其他生物分子相互作用的结构。
相比于其他人工智能模型,AlphaFold 3准确率比之前的工具显著提升,该模型由谷歌(Google)DeepMind和Isomorphic Labs的团队研发。

最新模型能预测含有蛋白质数据银行(Protein Data Bank)内几乎所有分子类型的复合物的结构。
这种用计算机解析蛋白质与其他分子复杂相互作用的能力,将拓展我们对生物过程的理解,并有望推动药物研发。
01 AlphaFold 3面世,将引领生物医学新革命
据介绍,AlphaFold 3以其前所未有的准确性,为药物设计领域注入了活力。
它不仅能够预测药物中常用的分子,如配体(ligands)和抗体(antibodies),与蛋白质的结合方式,还能揭示这些分子如何影响人体在健康和疾病状态下的蛋白质相互作用。
与传统的预测方法相比,AlphaFold 3在PoseBusters基准测试中表现出了比以往AI工具高50%的准确性,且不需要任何结构信息的输入。这使得AlphaFold 3成为首个超越基于物理工具的生物分子结构预测系统的人工智能系统。
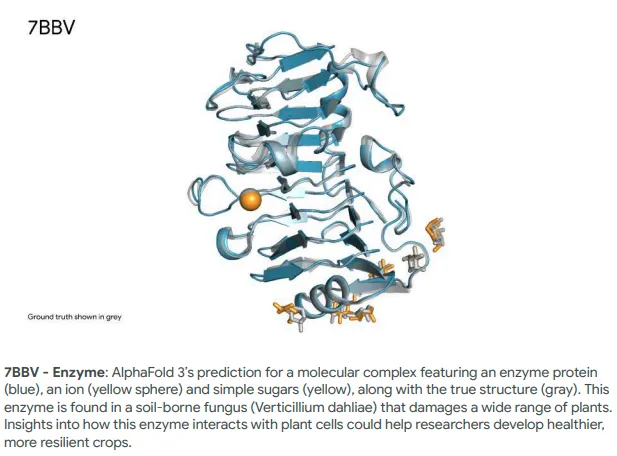
图片来自DeepMind
Isomorphic Labs的研究人员正将AlphaFold 3与一系列内部开发的AI模型相结合,共同推动药物设计领域的创新,他们不仅利用AlphaFold 3进行内部项目的药物设计,还与制药公司合作,共同开发新型药物。
药物研发是一个漫长而复杂的过程,其中最大的挑战之一就是找到能够与特定蛋白质结合并影响其功能的分子。AlphaFold 3通过预测蛋白质的结构和相互作用,可以帮助科学家们更快地找到潜在的药物靶点,并设计出更加精准和有效的药物分子。这将大大缩短药物研发的时间,降低成本,并有望为患者带来更好的治疗效果。
但AlphaFold 3也有一定的局限性,如约4.4%的结构会出现不正确的手性(一种对称特性),或是幻觉导致“飘带”(一种常见的蛋白质二级结构元素)的出现减少。AlphaFold 3模拟准确率的进一步提升,需要生成一个很大的预测集并对预测结构进行排序,而这会产生额外的计算成本。
02 AlphaFold3供科研人员免费使用
为了让更多的科学家能够利用这一强大的工具,DeepMind不仅发布了AlphaFold的源代码和训练数据,还建立了免费的AlphaFold Server供全球科学家使用。
AlphaFold Server平台的推出,意味着科学家无需承担高昂的实验成本和时间消耗,仅需通过简单的操作,即可利用AlphaFold3的强大能力,模拟由蛋白质、DNA、RNA以及特定配体、离子和化学修饰组成的结构。
AlphaFold Server的易用性是其最大的亮点之一。生物学家们无需具备强大的计算机操作能力或机器学习的专业知识,便能轻松上手,生成精确的预测结果。这一特性极大地降低了科研门槛,使得更多的研究者能够参与到蛋白质结构预测的研究中来,共同推动科学进步。
来自弗朗西斯·克里克研究所的Uhlmann实验室科学家Céline Bouchoux,对AlphaFold Server的推出给予了高度评价,她表示:“AlphaFold Server的推出不仅仅是预测结构,更是慷慨地提供访问权限:它允许研究人员提出大胆的问题并加速发现。”

实际上,早在AlphaFold 2时代,这一工具就已经帮助科学家们预测了数亿个结构,极大地推动了蛋白质结构生物学的发展。如今随着AlphaFold 3的加入,AlphaFold Server的预测能力再次得到了显著提升,使得更多的科学问题迎刃而解。
此次AlphaFold 3的推出,如同为生物世界戴上一副高清眼镜,让科学家们能够前所未有的观察细胞系统的复杂性和细节,包括结构、相互作用和修饰。这一全新的视角揭示了生命分子的内在连接,并有助于理解这些连接如何影响生物功能——比如药物的作用机制、激素的产生以及DNA修复的保健过程。
著名生物学家、中国科学院院士施一公教授曾评价AlphaFold,“依我之见,这是人工智能(AI)对科学领域最大的一次贡献,也是人类在21世纪取得的最重要的科学突破之一,是人类在认识自然界的科学探索征程中一个非常了不起的历史性成就。”
03 AlphaFold的迭代历程
从最初的构思到如今的广泛应用,AlphaFold以其惊人的预测能力和准确性,引领了结构生物学的一场革命。
DeepMind运用先进的深度学习和神经网络技术,着手研究如何从蛋白质的氨基酸序列预测其三维结构。这一领域长期以来一直困扰着科学家,因为传统的实验方法如X射线晶体学和核磁共振虽然精确,但耗时且成本高昂。
AlphaFold于2020年正式面世。AlphaFold 2以其卓越的性能和准确性,迅速成为了全球科研人员的得力助手。数百万研究人员利用AlphaFold 2在疟疾疫苗、癌症治疗、酶设计等多个领域取得了突破性的进展。
目前,AlphaFold 2的引用次数已超过20,000次,AlphaFold 2开发者因其杰出的科学影响力荣获多项殊荣,包括最近的生命科学突破奖。
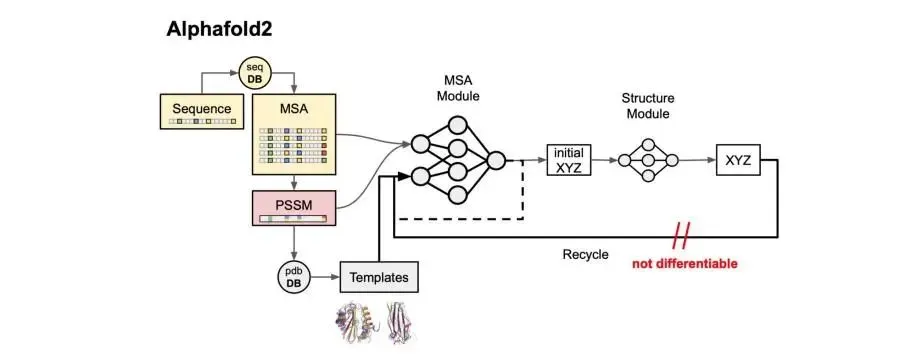
AlphaFold系列的成功不仅在于其技术上的卓越性,更在于其广泛的应用前景。在药物研发领域,它帮助科学家加速药物的研发过程。此外,它还为工业界带来更高的效率和经济效益。
参考资料
1.AlphaFold 3 predicts the structure and interactions of all of life’s molecules
2.DOI: 10.1038/s41586-024-07487-w



